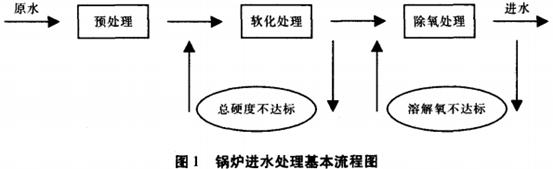
1 預處理
在原水使用前應進行沉淀、過濾、凝聚等凈化處理。對于高硬度或高堿度的原水,在離子交換軟化前,還應采用化學方法進行預處理。
化學預處理方法有:
a .石灰軟化處理。
將生石灰調制成石灰乳 CaO+H2O——Ca(OH) ,配置成一定濃度的石灰乳溶液后加入水中反應如下:
Ca(HCO3)2 +Ca(OH)2 —— 2CaCO3 + 2H2O
Mg (HCO3)2 + 2Ca (OH)2 —— Mg (O H)2 +2CaCO3 +2H2O
經石灰處理后 ,主要是消除水中鈣、鎂的重碳酸鹽,使硬度降低,但堿度不變。
b .石灰純堿軟化處理。
除加石灰外,還加入純堿Na2CO3,其作用是去除非碳酸鹽硬度。這種方法適用于硬度大于堿度的原水,反應式如下:
CaSO4+ Na2CO3——CaCO3+ Na2SO4
CaCl2+Na2CO3 ——CaCO3+ 2NaCl
MgSO4+Na2CO3—— MgCO3 + Na2SO4
MgCO3 +Ca(OH)2 —— Mg (OH)2 + CaCO3
c .石灰----石膏軟化處理。
當原水中堿度大于硬度時,單純石灰軟化只能降低與碳酸鹽硬度相應的那部分堿度,而其余的鈉鹽堿度是不能除去的。采用同時加入石灰和石膏的方法,則可在軟化水的同時降低水的鈉鹽堿度,反應式為:
4NaHCO3 +2CaSO4 +Ca (OH)2 = 2CaCO3 +2 Na2SO4+2H2O
2 軟化處理
采用離子交換軟化,基本原理是原水流經陽離子交換劑時,水中Ca2+、Mg2+等陽離子被交換劑吸附,而交換劑中的可交換離子(Na+或H+)則溶入水中,從而除去了水中鈣鎂離子,使水得到了軟化。離子交換軟化法有以下幾種。
a.鈉離子交換軟化法。
鈉離子交換劑是工業鍋爐最常使用的離子交換劑,化學分子式用NaR表示,當原水經鈉離子交換劑時,水中的鈣、鎂離子被鈉離子置換,其反應式為:
碳酸鹽硬度:
Ca(HCO3)2+2NaR——CaR2+2NaHCO3
Mg(HCO3)2+2NaR——MgR2+2NaHCO3
非碳酸鹽硬度:
CaSO4+2NaR——CaR2+Na2SO4
MgSO4+2NaR——MR2+Na2SO4
鈉離子交換法不僅可以除去永久硬度,也可以除去暫時硬度,而且處理前后水中的總堿度保持不變。處理后水的含鹽量增加,因為鈣鎂鹽等當量地轉變成鈉鹽,而鈉的當量值(23)比鈣和鎂的當量值(20.04)和(12.16)高,所以用毫克每升表示水的含鹽量將有所提高。
隨著交換過程的不斷進行,交換劑中的Na+被大部分置換,出水中便含有Ca2+、Mg2+(即出現了硬度),當硬度達到一定范圍時,此水已不符合鍋爐給水標準,說明交換劑已失效,此時就要再生,恢復交換劑的軟化能力,再生劑是食鹽(NaCI)。
再生過程中,使含有大量Na+的氯化鈉溶液通過失效的交換劑層,將離子交換劑所吸附的Ca2+、Mg2+強行排除掉,而Na+被交換劑所吸附,使交換劑重新恢復交換能力,其反應式如下:
CaR2+2Na+=2NaR+Ca2+
MgR2+2Na+=2NaR+Mg2+
b.部分鈉離子交換軟化法。
即只是讓原水的一部分經過離子交換器,另一部分直接進入水箱。經鈉離子交換后軟水中NaHCO3在水箱中受熱分解成為Na2CO3,利用這些Na2CO3,去軟化未經鈉離子交化器中的生水永硬,同時消除一部分堿度。
部分鈉離子交換軟化有如下特點:①減少鈉離子交換器的負荷,可減小設備容量;②可以軟化、除堿而不需要另加藥劑,并減少原用食鹽的消耗量;③軟化不徹底,尤其是當水中的永硬與總硬度之比小于0.5,軟化效果更差;因此,這種方法只適用于小型鍋爐,當水中的永硬與總硬度之比大于0.5時,作為軟化除堿使用。
c.氫一鈉離子交換軟化法。氫離子交換軟化水的原理是利用離子交換劑中氫離子置換原水中的鈣鎂離子,反應式如下:
碳酸鹽硬度:
Ca(HCO3)2+2HR----CaR+2H2O+2CO2
Mg(HCO3)2+2HR----MgR+2H2O+2CO2
非碳酸鹽硬度:
CaSO4+2HR----CaR+H2SO4
CaCl+2HR----CaR+2HCl
MgSO4+2HR----MgR+H2SO4
MgCl2+2HR----MgR+2HCl
由此可見,氫離子交換還有除鹽的作用,除鹽的量與水中的碳酸鹽硬度的摩爾數相等。氫離子交換后水中有游離酸,產生的酸量與水中的非碳酸鹽硬度的摩爾數相等。因此不能作為鍋爐給水,氫離子交換不能單獨使用,必須與鈉離子交換聯合使用,稱為氫----鈉離子交換,使產生的游離酸與經鈉離子交換后生成的堿相中和,達到除堿的目的。
3 除氧處理
水中往往溶解有氧、二氧化碳等氣體,使鍋爐易發生腐蝕。GB1576----2001規定蒸發量>16t/h的鍋爐必須除氧,且含氧指標≤0.1mg/L(此指標范圍內氧腐蝕的速度緩慢),而淡水中氧的溶解極限如表2,水的溫度升高,溶解度減小。
| ||||||||||||||||||||||||||||||
O2+2H2O+4e----4OH-
Fe----Fe2++2e
眾所周知,溶解氧與腐蝕速度成正比,即含氧量增大,腐蝕加劇,含氧量減小,腐蝕減緩。若將pH值提高,則能減緩腐蝕,但實際上即使把pH值提高到10~12,依然有氧腐蝕。而當水中沒有溶解氧時,只要將pH值調到9.5~10就會大為減緩乃至避免腐蝕。工業鍋爐一般采用熱力除氧,即利用引入具有一定壓力的蒸汽將水加熱至沸騰,水中的氧根據表2因溶解度減少而逸出。再將逸出的氧隨少量凝結的蒸汽一起排出,以保證給水質量。熱力除氧法的淋水盤式除氧器是一種理想的除氧裝置,進水加熱0.02~0.025MPa下的沸點105℃,在除氧器內噴淋到足夠的細度可以有效地除去氧氣。此法還可以有效地節約熱能。
鍋外水處理流程圖
 |


